 Leverkusen
Leverkusen
"Kombinatorische Chemie: Der erste Schritt zur innovativen Arznei"
Aus den Ausführungen von Dr. Klaus Frobel, Leiter Life Science Center Naturstoffe im Geschäftsbereich Pharma der Bayer AG
(Es gilt das gesprochene Wort)
Sehr geehrte Damen und Herren,
wenn im Hochleistungsscreening ein Treffer identifiziert wird, ist die Pharma-Forschung noch lange nicht bei einem klinischen Entwicklungskandidaten oder einem fertigen Wirkstoff angelangt. Die nächste Hürde besteht in einer Optimierung des Treffers zu einem klinischen Entwicklungskandidaten.

Eine Reihe von zusätzlichen Anforderungen muss erfüllt werden, die weit über das Screening hinausgehen. Dieser Prozess der Optimierung ist ein multidisziplinärer und komplexer Vorgang, der eine nahtlos abgestimmte Arbeit ganzer Forscherteams aus Chemikern, Biologen und Medizinern für durchschnittlich 18 Monate bis zwei Jahre erfordert.
Auf der einen Seite dieses wechselseitigen Prozesses steht die medizinische Chemie, die über ein mächtiges Repertoire sehr leistungsfähiger Methoden verfügt, um niedermolekulare Wirkstoffe synthetisch im Labor herzustellen oder vorhandene zu verändern. Dazu gehören die Methoden der klassischen organischen Synthese ebenso wie das Wirkstoff-Design am Computer. Die chemische Synthese erfolgt nicht rein intuitiv oder beliebig; sie wird nicht nur durch Design-Aspekte oder die synthetische Machbarkeit allein gesteuert. Sie bedarf vielmehr eines Gegenspielers, der biologischen Prüfung.
Mit der biologischen Prüfung wurde ein erweitertes Arsenal von Prüfverfahren, die Screeningkaskade, eingeführt. Sie umfasst Untersuchungen an einzelnen Targetmolekülen, ganzen Zellen oder gesamten Organismen, den Tiermodellen. Diese Prüfverfahren nähern sich mehr der therapeutischen Anwendung im jeweiligen Indikationsgebiet als das Hochleistungsscreening allein.
Die biologischen Untersuchungen liefern dem medizinischen Chemiker Informationen darüber, ob die Substanzvariationen eventuell zu einer verbesserten Wirkung bei einer bestimmten Krankheit führen. Dies wird an verschiedenen Kriterien gemessen: der Wirkspezifität, Wirkstärke, Wirkdauer und Bioverfügbarkeit inklusive Metabolismus.
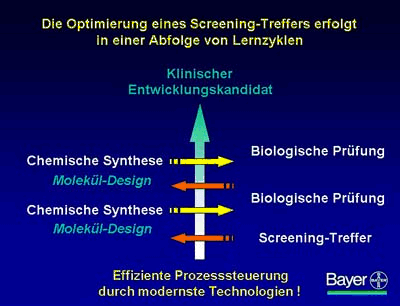
Der Optimierungsprozess wird also durch das Wechselspiel zwischen neu synthetisierten chemischen Verbindungen und den biologischen Ergebnissen aus spezifischen, krankheitsrelevanten Prüfmodellen vorangetrieben.
In der Designphase werden zunächst viele Informationen verarbeitet und eine neue Gruppe von Verbindungen unterschiedlicher Größe hergestellt. Die neue Molekülgruppe wird anschließend einer biologischen Prüfung unterzogen. Der Prozess pendelt hin und her; in diesen Lernzyklen soll der beste Entwicklungskandidat herausgefiltert werden.
Für die Forscher besteht die Herausforderung darin, diesen Prozess so effizient wie möglich zu gestalten: In möglichst kurzer Zeit soll mit einem Minimum an Ressourcen der bestmögliche klinische Entwicklungskandidat für die Zielindikation identifiziert werden.

Der medizinische Chemiker betätigt sich dabei als Molekül-Architekt, der Verbindungen mit bestimmten Struktureigenschaften aufbaut. Das biologische Target, das es zu beeinflussen gilt, kann als ein Schloss aufgefasst werden; die Suche nach dem Wirkstoffmolekül als die Suche nach dem dazu passenden Schlüssel. Nur der Schlüssel, der das Schloss öffnet, entspricht einem potenziellem Medikament.
Dabei stellen sich zwei Aufgaben: Zunächst muss der passende Rohling, die Leitstruktur, identifiziert werden; anschließend muss er den passenden Schliff erhalten. Der Schliff beim Schlüssel ist mit den pharmakophoren Gruppen zu vergleichen.
Solche Gruppen liegen an der Kontaktfläche zum Target, dem menschlichen Protein-Molekül. Sie bestimmen die Stärke der Wechselwirkung, das Klebeverhalten. Die Kriterien müssen bis ins Detail korrekt erfüllt werden – eine schwierige Aufgabe, da in der Regel über die dreidimensionale Struktur des Zielmoleküls wenig bekannt ist. Das Schloss wird quasi im Dunkeln gesucht.

Das Target selbst ist mit einer dreidimensionalen, also räumlichen Landschaft mit Hügeln und Tälern zu vergleichen. Die Chemiker müssen nun eine Substanz finden, die sich beispielsweise den Talstrukturen genau anpasst. Das Molekül darf nicht so entworfen werden, dass chemische Gruppen mit den Bergen in Konflikt geraten. In einem solchen Fall wird die Wechselwirkung mit dem Zielmolekül aufgehoben.
Wenn der passende Schlüssel gefunden worden ist, muss er sich im Schloss drehen lassen. Dieser Vorgang stellt die eigentliche Wechselwirkung des Schlüssels mit dem Schloss dar. Das bedeutet auf der chemischen Ebene, dass mit bestimmten Gruppierungen des Targets, die für seine Funktion verantwortlich sind, bestimmte Wechselwirkungen ablaufen müssen. Sie können über elektrische Ladungen, über fett- oder wasserähnliche Strukturteile des Moleküls erfolgen. Die Chemiker müssen also nicht nur die passenden Moleküle finden, sondern auch solche, die an den richtigen Klebestellen eine Wechselwirkung entfalten.
Denn schon durch relativ kleine chemisch-strukturelle Variationen kann die biologische Wirkung einer Verbindung drastisch verändert werden. Ähnliche Strukturen mit gleicher Grundstruktur können demnach ganz andere Wirkorte und Wirkmechanismen haben.

Bei der Variation der Moleküle stehen dem Chemiker praktisch unbegrenzte Kombinationsmöglichkeiten offen. Hat ein kleines Wirkstoffmolekül noch überschaubare 109 Variationsmöglichkeiten, so steigt die Zahl bei einem größeren auf deutlich über 1026 an. Eine unvorstellbare große Zahl, wenn man bedenkt, dass man die Anzahl der Sterne im Universum auf "nur" 1020 bis 1022 schätzt.
Wie wird nun möglichst schnell und effizient in einem Universum von Strukturmöglichkeiten der passende Wirkstoff identifiziert? Da eine sichere Vorhersage der optimalen Wirkstruktur nicht möglich ist, wird der Prozess vom Zufall gesteuert. Vor allem bestimmen die Erfahrung des medizinischen Chemikers zusammen mit einigen wichtigen Grundregeln die Vorgehensweise.
Der Chemiker weiß aus Erfahrung, welche Strukturmerkmale besonders gut mit den Targets in Wechselwirkung treten. Die Interaktion der Proteine mit kleinen Wirkstoffmolekülen folgt allgemeinen Gesetzmäßigkeiten. Daraus können Hinweise gezogen werden, welche Strukturvariationen sich im Optimierungsprozess wahrscheinlich vorteilhaft auswirken.

In seltenen Fällen erhält der Forscher durch Analogieschlüsse aus Screeningdaten oder Strukturinformationen des Zielproteins Hinweise. Dies trifft besonders für Enzyme zu, weil Gruppen von Enzymen gleichen Umsetzungsmechanismen folgen. Für die Chemiker gilt, das "Lotteriespiel" der Wirkstoffsuche intelligent zu planen.
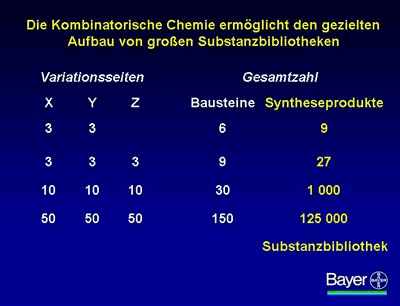
Mit der Kombinatorischen Chemie kann – im Gegensatz zur klassischen Synthese – ein Vielfaches an Molekülbausteinen gleichzeitig systematisch variiert werden. Dabei gibt es verschiedene Labortechniken zur Durchführung einer Kombinatorischen Synthese. So ist es möglich, aus 150 Bausteinen mit Hilfe der kombinatorischen Chemie eine Substanzbibliothek mit 125.000 verschiedenen Syntheseprodukten herzustellen.
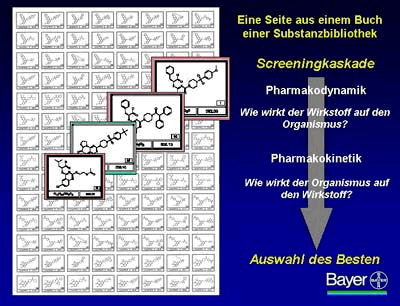
Auf einer Seite eines Buches aus der Substanzbibliothek befinden sich Untergruppen eines Strukturtyps, z.B. über 100 chemische Strukturen, die um eine bestimmte Grundstruktur herum systematisch variiert wurden. Das Buch wird so angelegt, dass es die Ergebnisse des primären Treffers am besten widerspiegelt.
Auf diese Weise arbeiten sich die Chemiker Stück für Stück an ihr Ziel, einen Entwicklungskandidaten zu finden, heran. Die meisten Moleküle in dem Buch sind – wie man aus der Schlüssel-Schloss Analogie durchaus erwarten kann – mit großer Wahrscheinlichkeit inaktiv; jedes, zu Beginn des Prozesses vielleicht nur schwach aktive Molekül gibt jedoch Anhaltspunkte für das nächste Bibliotheks-Design. Ein erneutes Durchlaufen der Screeningkaskade erlaubt so, Schritt für Schritt die wirksamsten Strukturen zu identifizieren.
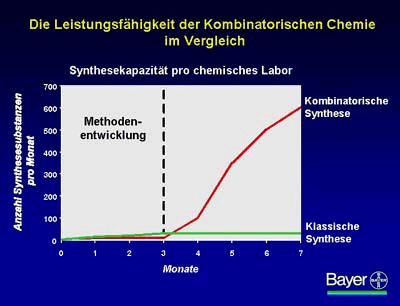
Die Leistungsfähigkeit der Kombinatorischen Chemie ist signifikant höher als die der klassischen Synthese, die noch vor wenigen Jahren zum alleinigen Standard gehörte. Man rechnet durchschnittlich mit nicht mehr als 100 bis 150 Substanzen, die pro Jahr in einem klassischen chemischen Labor synthetisiert werden können. Bei der kombinatorischen Chemie benötigen die Chemiker zunächst etwa drei Monate, um die geeigneten Methoden zu entwickeln. Dabei greifen sie sehr intensiv auf die Mithilfe der klassischen Synthese zurück. Ist die Methodenoptimierung erfolgreich, steigen die Syntheseraten deutlich, mindestens um das 30- bis 100fache, an.

Das Ergebnis: eine gewaltige Anzahl von Prüfsubstanzen, die gelagert und jederzeit verfügbar gemacht werden müssen. Zurzeit bauen wir schon in der zweiten Generation ein Subszanzlager auf. Hier haben mehr als sechs Millionen Verbindungen Platz. Die neue Herausforderung ist die Just-in-time-Anforderung mit modernster Informationstechnologie. D.h., es müssen für jedes Substanzgefäß folgende Fragen beantwortet werden können: Welche Substanz? Wieviel Gramm? Menge? Art? Eigenschaft? Verfügbarkeit? Dies wiederum müssen mit den Ergebnissen aus dem Hochdurchsatzscreening verknüpft werden – eine logistische Herausforderung.

Mit Einführung der Kombinatorischen Chemie wurde die Arbeit im medizinischen chemischen Labor grundlegend verändert. Automation und computergesteuerte Syntheselogistik prägen heute das Bild. Dabei gehört es zu den Arbeitszielen, die methodische Syntheseerfassung möglichst originell und innovativ an die modernen Syntheseprozesse anzupassen.
Der Weg vom Hit über die Wirkstoffoptimierung zum Entwicklungs-kandidaten kann dadurch weitaus effizienter gestaltet werden als mit den klassischen Verfahren allein. Die größere Anzahl von chemischen Substanzen, die dem Auswahlprozess nach pharmakodynamischen und pharmakokinetischen Kriterien unterworfen werden, bildet eine signifikant verbreiterte molekulare Basis und erlaubt so einen Qualitätsgewinn für die Entwicklungskandidaten. Durch die schnellere Synthese wird ein Zeitgewinn erzielt und der Suchprozess beschleunigt – ein nicht zu unterschätzender Vorteil im Wettbewerb um innovative Arzneimittel.
Quelle: Pressemitteilung der Bayer AG vom 20.06.2000
Pharma-Forschung 2000plus: Mit High-Tech zu neuen Medikamenten
Hauptseite
Nachrichten
Anmerkungen
Letzte Änderungen: 21.06.2000
 Leverkusen
Leverkusen Leverkusen
Leverkusen









