 Leverkusen
Leverkusen
"Hochleistungsscreening: Der schnelle Weg zur richtigen Substanz"
Aus den Ausführungen von Dr. Martin Bechem, Leiter Molekulare Screening Technologie im Geschäftsbereich Pharma der Bayer AG
(Es gilt das gesprochene Wort)
Sehr geehrte Damen und Herren,
seit Beginn der Pharma-Forschung vor ca. 100 Jahren gehört es zur zentralen Aufgabe der Medikamentenentwicklung, neue Wirkstoffe zu suchen.
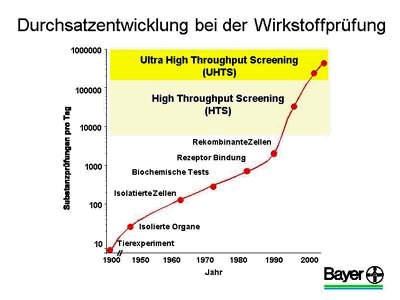
Die erste Abbildung zeigt, wie sich die Suche nach neuen Wirkstoffen, das Screening, über die Jahre verändert hat. So ist insbesondere die Geschwindigkeit, mit der chemische Substanzen bezüglich ihrer pharmakologischen Wirkung untersucht werden, dramatisch angestiegen.
Während die Tests früher meist direkt im Tierversuch oder später an isolierten Organen erfolgten, finden seit den 80er Jahren die Prüfungen mit zunehmender Tendenz an bestimmten Zielstrukturen, den pharmakologischen Targets, statt. In Bindungs- und Enzym-Assays liegen die Targets isoliert vor, und es wird geprüft, ob sich die getesteten Substanzen an ein Target anlagern und ob sie es beeinflussen können.
Der Durchsatz solcher Screeningverfahren lag bis Mitte der 90er Jahre bei bestenfalls einigen hundert Substanzen pro Tag und Labor. Erst die Laborautomation und der Einzug der Robotertechnik ermöglichten einen schlagartigen Anstieg auf mehrere 10.000 Substanzen pro Tag. Das HTS oder Hochdurchsatzscreening war entwickelt worden. Ich möchte Ihnen heute über die neueste Entwicklung auf diesem Gebiet, dem UHTS oder Ultra-Hochdurchsatzscreening, berichten, bei dem zukünftig mehrere 100.000 Substanzen pro Tag getestet werden können.
Da das moderne Screening nicht mehr direkt im Organismus durchgeführt wird, müssen die Zielstrukturen oder Targets zunächst isoliert und in ein Testsystem, auch Assay genannt, eingebaut werden. Die Targets kann man sich am einfachsten als kleine, molekulare Maschinen vorstellen, die auf vielfältige Art und Weise die Funktionen der Zellen des Körpers ermöglichen.
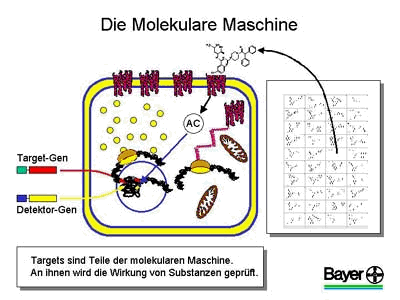
Bei einer Krankheit kommt es zu einer Fehlfunktion dieser molekularen Maschinen, die dann zunächst schädliche Auswirkungen auf einzelne Zellen des Körpers und später dann auch auf den gesamten Organismus hat. So zeigen beispielsweise bei Krebs einige Targets eine stark erhöhte Aktivität, die dann zur unkontrollierten Vermehrung dieser Zellen führt.
Im Screening versucht man nun chemische Substanzen zu finden, die in der Lage sind, diese molekularen Targets in geeigneter Weise zu beeinflussen, d. h. entweder zu hemmen oder zu aktivieren. Da man bei den meisten Targets keinerlei Vorhersagen über geeignete chemische Wirkstoffe machen kann, beginnt man im ersten Schritt mit der systematischen Austestung möglichst aller verfügbaren Substanzen. Ziel ist hierbei, erste Hinweise auf neuartige Wirkungen dieser bekannten chemischen Strukturen zu finden, die dann weiter verbessert und am Ende zu einem neuen Arzneimittel entwickelt werden können. Diese ersten gefundenen erfolgreichen Substanzen nennt man Leitstrukturen.
Zum Auffinden von Leitstrukturen benutzt man Tests, die mit Hilfe einer messbaren Reaktion die Wirkung der chemischen Substanzen erfassen können. Alle Testsysteme haben Vor- und Nachteile, so ist beispielsweise der Durchsatz an Substanzen im Tierexperiment am geringsten. Der Informationsgewinn ist jedoch am größten, weil die Pharmakologen auch erfahren, wie eine Substanz im Organismus wirkt, wie sie aufgenommen, verstoffwechselt und wieder ausgeschieden wird.
Allerdings ist von allen Testsystemen der Aufwand beim Tierexperiment am höchsten, bei den Bindungs-Assays dagegen am geringsten. Bei den Bindungs- und Enzym-Assays wird das molekulare Target isoliert und die Wirkung der Substanzen direkt im Reagenzglas gemessen. Der Assay wird dabei so eingestellt, dass bei einer Substanzwirkung sich z. B. die Farbe der Lösung verändert. Beim Bindungsassay wird nur gemessen, ob die Substanzen am molekularen Target kleben bleiben. Im Enzym-Assay kann direkt die geänderte Funktionsweise der molekularen Maschine erfasst werden.
Bei der Abwägung zwischen Aufwand und Nutzen wurde deshalb bei Bayer die Entscheidung getroffen, mit Enzym- und zellulären Assays zu arbeiten, die einen mittleren Informationsgewinn und Schwierigkeitsgrad haben. Im zellulären Assay werden lebende tierische oder menschliche Zellen untersucht. Neben der Funktion der Targets können so auch die geänderten Aktivitäten der Zellen gemessen werden. Dies erlaubt eine wesentlich bessere Vorhersage einer Wirkung auf den Gesamtorganismus.
Zur Auffindung der vielfältigen Substanzen und zur Vermeidung von Fehlern muss die Funktion des molekularen Targets im Test möglichst präzise nachgestellt werden. Dies kann man durch den Wiedereinbau der isolierten Gene und Targets in lebende Zellen erreichen, die dann besonders gut für die Testung geeignet sind.
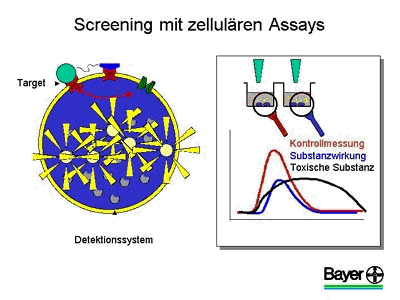
Anders als bei den Enzym-Assays hat man hier jedoch nicht die Möglichkeit, die Wirkung der Substanzen auf die Zellen durch eine einfache Veränderung der Farbe der Lösung, in der sich die Zellen befinden, nachzuweisen.
Bei der Suche nach geeigneten Substanzen hilft ein gentechnischer Trick: In die Zelle wird neben dem Target auch ein Detektor-Gen eingeschleust. An seiner Funktion ist zu erkennen, ob das Target beeinflusst worden ist. Dazu wird das isolierte Leuchtgen (Luziferase) des Glühwürmchens genutzt. Dank gentechnischer Manipulation leuchtet es nur dann, wenn das Target durch ein Molekül aktiviert wurde. Anschließend kann an der Menge des ausgestrahlten Lichts gemessen werden, ob ein Target gehemmt wurde.
In Abbildung drei ist der Aufbau einer solchen Screening-Zelllinie schematisch dargestellt. In die Zelle ist in diesem Fall ein Rezeptor eingebaut, der sich in der Zellmembran befindet und die Aktivität der Zelle in Abhängigkeit von bestimmten körpereigenen Überträgerstoffen steuert. Bei der Zugabe des Überträgerstoffes wird zunächst der Rezeptor und damit auch das in die Zelle eingebaute Detektorgen aktiviert. Vom Messsystem wird ein kurzes, ca. 10 – 20 sec. anhaltendes, Lichtsignal registriert.
Beim Screening werden die Zellen zunächst einer Kontrollmessung unterzogen, und eine Kontrollkurve wird erstellt. Anschließend wird die Substanz zugegeben. Ihre Wirksamkeit kann am Verlauf der Messkurve abgelesen werden. Zudem kann ermittelt werden, ob sich die Substanz toxisch verhält und die Testzellen abtötet, wie im dritten Beispiel gezeigt wird. Zusätzlich können direkte erste pharmakologische Experimente erfolgen, die Aufschluss über die Targetspezifität und auch Funktionsweise ergeben.
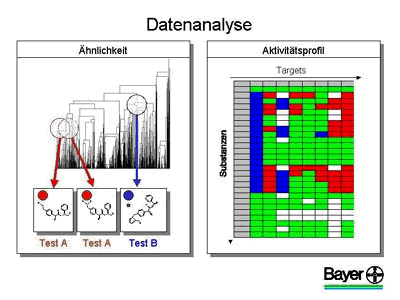
Die Substanzen werden in verschiedenen Testsystemen gegen verschiedene Targets getestet, wie Abbildung vier zeigt. Substanzen, die in mehreren Tests und bei verschiedenen Zellen eine Wirkung haben, können nicht spezifisch sein und werden später im Tierexperiment wahrscheinlich unerwünschte Nebenwirkungen aufweisen. Dies wird im Computer erkannt und die Substanz auf Rot gesetzt. Nur "grüne" Substanzen werden weiter verfolgt. Gleichzeitig kann der Computer analysieren, ob ähnliche Substanzen auch in dem gleichen Test gewirkt haben. Hieraus erhält der Chemiker Hinweise auf eine mögliche Optimierung dieser Substanzen.
Durch die Entwicklungen in der modernen Gentechnik und Genomforschung sind heute alle ca. 100.000 Gene des Menschen bekannt. Hiervon eignen sich etwa zehn Prozent als mögliche Targets für eine Pharmakotherapie. Diesen Targets steht die ungeheure Anzahl von ca. 1063 chemischen Molekülen gegenüber, die als Wirkstoffe in Frage kommen. Die Identifizierung neuartiger Wirkstoffe verlangt daher die Testung von Millionen von Molekülen auf den nun bekannten Targets. Dies war und ist mit den Methoden des bisher entwickelten HTS sowohl aus technischen als auch aus Kostengründen nicht möglich.
Seit 1996 wurde daher bei Bayer mit Kooperationspartnern eine neue Ultra-Hochdurchsatz-Plattform (UHTS) entwickelt, die heute zu einem weltweit akzeptierten Standard gehört.
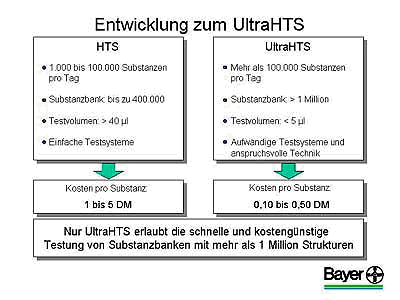
Mit dem UHTS können bis zu 200.000 Substanzen pro Tag getestet werden. Dabei ist das Volumen pro Testpunkt bei diesem neuen System wesentlich kleiner als beim herkömmlichen HTS. Damit können vor allem die teuren Reagenzien eingespart und der Testsubstanzverbrauch reduziert werden. Als Folge ergibt sich eine Kostenreduktion um den Faktor 10 pro Testsubstanz. Allerdings mussten aufwendigere Testsysteme und anspruchsvollere Techniken entwickelt werden.

Die Komponenten des neuen UHTS–Systems sind in Abbildung sechs dargestellt. Zunächst wurden zusammen mit der Firma Greiner Mikrotiterplatten entwickelt und bezüglich verschiedener Testprinzipien optimiert. Auf jeder Testplatte befinden sich 1536 Vertiefungen, in die die gelösten Wirkstoffe und das Testsystem oder die Zellen hineinpipettiert werden. Das Verfahren erlaubt biochemische Tests mit isolierten Zielstrukturen ebenso wie Tests an lebenden Zellen, die eine größere Aussagekraft haben. Zusätzlich sind die Platten dazu geeignet, große Substanzbibliotheken auf engstem Raum zu speichern. Die Größe der einzelnen Vertiefungen dieser Mikrotiterplatten ist kleiner als ein Streichholzkopf und kann vom Volumen her nicht einmal einen Regentropfen fassen.
Als Ergebnis der Kooperation mit der Cybio AG konnte ein neuartiger Pipettierroboter eingeführt werden. Dessen 384 parallel angeordnete Pipetten fahren automatisch in die Löcher hinein und setzen die gelösten Substanzen ab. Den Schlusspunkt dieser Kooperation bildete eine vollautomatische Screeningmaschine mit einer eigens entwickelten Software. Bei Bayer ist zusätzlich ein Messverfahren entwickelt worden, bei dem das geringe Lichtsignal mit hoher zeitlicher Auflösung und gleichzeitig für alle 1536 Vertiefungen einer Testplatte sichtbar gemacht und gemessen werden kann.
Besonderer Vorteil des von Bayer entwickelten Systems ist, dass es auch mit lebenden Zellen arbeiten und dadurch im UHTS die Vorteile dieser Testsysteme nutzen kann. Es zeigte sich sogar, dass die bisher verwendeten Zellen ohne Änderungen auch im UHTS eingesetzt werden können. Das erspart Zeit und Arbeit bei der weiteren Optimierung der Substanzen und garantiert eine hohe Erfolgsrate im gesamten Forschungsprozess. Zusätzlich werden die Chance der Übertragbarkeit auf Tierexperimente sowie die Vorhersage für die Anwendung am Menschen verbessert. Diese UHTS-Technologie ermöglicht damit erstmals in wenigen Tagen die schnelle, zuverlässige Testung von Millionen von Substanzen.
Im Screening wird jedoch nicht gleich ein neuer Wirkstoff gefunden. Bis dahin ist es noch ein weiter Weg.
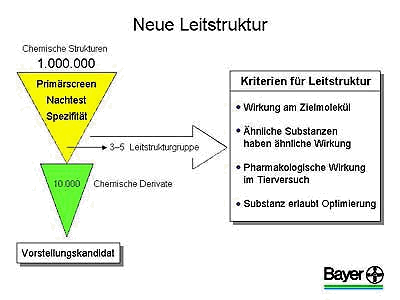
Vielmehr wird zunächst eine Leitstruktur gesucht, die einen Hinweis auf einen möglichen Wirkstoff oder eine potenzielle Wirkung im menschlichen oder tierischen Organismus erbringt.
Aus einer Million getesteter Substanzen können durchschnittlich drei bis fünf Leitstrukturen herausgefiltert werden. Im weiteren Prozess der Wirkstofffindung müssen die Strukturen noch chemisch variiert werden. Zudem werden viele verwandte Strukturen getestet, um einen Entwicklungskandidaten zu erhalten.
Bevor eine Leitstruktur endgültig akzeptiert wird, die auch möglicherweise auf eine falsche Fährte führen kann, müssen folgende Fragen geklärt werden:
- Wie wirkt die Substanz am Target?
- Gibt es ähnliche Strukturen, die ähnlich wirken?
- Wirken die Strukturen auch im Tierexperiment?
- Kann die Substanz auch weiter verarbeitet werden, z. B. zu einer Tablette?
Trotz sorgfältiger Auswahl kann von ca. 20 Leitstrukturen im Durchschnitt am Ende nur eine zu einem neuen Medikament entwickelt werden.
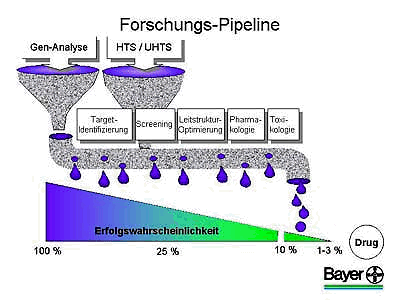
In der gesamten modernen Forschungs-Pipeline gibt es zwei große Trichter, bei denen die Forscher die Qual der Wahl haben: In der Genomforschung muss erst das richtige Target und im Screening die richtige Substanz ausgewählt werden. Doch bei den hohen Verlusten bleiben trotz der verwendeten großen Trichter am Ende nur wenige Projekte übrig. Von 100 ausgewählten und bearbeiteten Targets bleiben nach der weiteren Optimierung der Leitstruktur, der pharmakologischen und toxikologischen Prüfung nur ein bis drei potenzielle neue Wirkstoffe übrig, die eine Marktchance haben.
Trotz dieser Risiken und der hohen Ausfallquote wurde durch das Hochdurchsatzscreening der entscheidende Grundstein für eine erfolgreiche moderne Pharma-Forschung gelegt. So wurden im Jahr 1999 bei Bayer insgesamt neun innovative Entwicklungskandidaten für verschiedene Indikationen gefunden, die zu 75 Prozent aus dem HTS stammen.
Quelle: Pressemitteilung der Bayer AG vom 20.06.2000
Pharma-Forschung 2000plus: Mit High-Tech zu neuen Medikamenten
Hauptseite
Nachrichten
Anmerkungen
Letzte Änderungen: 21.06.2000
 Leverkusen
Leverkusen Leverkusen
Leverkusen






