 Leverkusen
Leverkusen
"Bayer und Millennium Inc.: Auf der Spur krankheitsauslösender Gene"
Aus den Ausführungen von Dr. Stefan Lohmer, Leiter Molekularbiologische Forschung,
Bayer S.p.A., Mailand, Italien
(Es gilt das gesprochene Wort)
Sehr geehrte Damen und Herren,
die Genomforschung oder Genomics ist heute der Schlüssel zur Suche nach neuen Medikamenten.
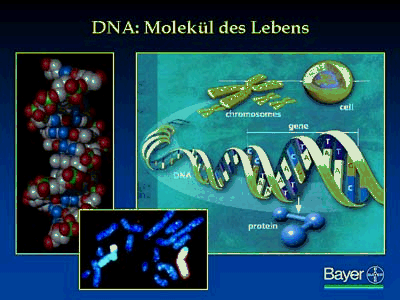
Mit Spitzentechnologien wird das Molekül des Lebens und Bestandteile aller Gene, die DNA, entschlüsselt. Somit ist auch die Aufklärung und Analyse des Genoms, des kompletten Satzes von Genen in einem Organismus, möglich geworden. Auf diese Weise kann die Bauanleitung für die Proteine ermittelt werden, die in Form von Genen in jeder Zelle vorliegt. Die Proteine übernehmen im Körper die lebenswichtigen Funktionen, sie können aber auch Krankheiten auslösen falls Veränderungen in der Sequenz oder in der Expressionshäufigkeit vorhanden sind.
Für die Pharma-Forschung sind diejenigen Proteine interessant, an denen neue Wirkstoffe ihre ganze Aktivität entfalten. Die Kenntnis dieser Angriffspunkte oder Targets ist in vielen Fällen bereits auf die molekulare Ebene vorgedrungen.
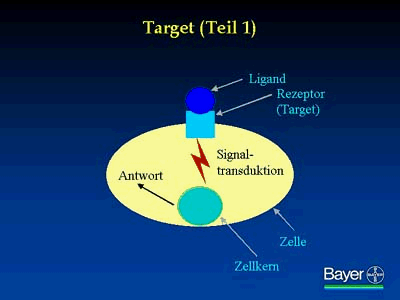
Häufig liegt ein Target an der äußeren Zellmembran als Rezeptor vor, der zur hoch spezifischen Bindung von bestimmten Molekülen, den Liganden, befähigt ist.
Infolge der Rezeptor-Ligand-Wechselwirkung werden bestimmte Signale induziert, beispielsweise Veränderungen in der Aktivität eines Enzyms oder im Transport von Ionen. Dieser Vorgang führt dann zu einer charakteristischen physiologischen Reaktion der Zelle.
Viele Moleküle, beispielsweise Hormone, Antigene, Viren und Glykoproteine, aber auch Arzneimittel, vermitteln ihre biologischen Effekte über die Bindung an zelluläre Targets. Auf der Zellmembran befinden sich etwa 100 bis 1.000 solcher hoch spezifischer Rezeptoren.
Rezeptoren sind für die Pharma-Forschung wichtige Ansatzpunkte, weil sie ihre Liganden mit hoher Spezifität und Affinität binden.
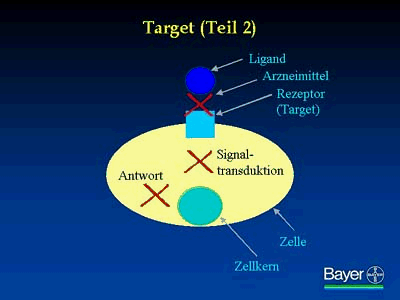
Deshalb können ausgesuchte krankheitsrelevante Rezeptoren auch hoch spezifisch mit Wirkstoffen blockiert werden, um damit eine Signalübertragung unmöglich zu machen bzw. zu reduzieren und so eine pathologische Zellantwort zu verhindern.

Mit den bisherigen herkömmlichen Methoden war die Pharma-Forschung nicht übermäßig erfolgreich. In den letzten 100 Jahren konnten kaum 500 Targets identifiziert werden.

Eine Analyse aus dem Jahr 1996 hat ergeben, dass sämtliche bis dahin entwickelten Medikamente gegen 417 unterschiedliche Targets gerichtet sind, darunter Rezeptoren, Ionenkanäle und Enzyme des menschlichen Körpers. Ausgenommen von der Untersuchung waren Antiinfektiva, also Wirkstoffe gegen Zielmoleküle von Bakterien, Viren und Parasiten.
Der bisherige Ansatz in der Entwicklung von Medikamenten beruhte auf der Erfahrung (Empirie) und war zufallsorientiert (opportunistisch) ausgerichtet. Empirisch, weil die ursächliche Krankheitsgenese meist nicht oder nur unvollständig bekannt war. Die Medikamente wurden mittels chemischer oder pharmakologischer Versuche entdeckt.
Opportunistisch, weil bestimmte, bereits bekannte Targets überproportional vertreten sind. Etwa die Hälfte aller Medikamente sind nur gegen eine biochemische Rezeptorklasse, die Klasse der G-Protein-gekoppelten Rezeptoren, gerichtet. Enzyme als Angriffspunkte pharmakologischer Interaktion machen 22 Prozent aller Targets aus, gefolgt von Hormonen und Wachstumsfaktoren. Für 15 Prozent aller Medikamente sind die Targets bisher unbekannt.
Obwohl zirka 30.000 Erkrankungen des Menschen bekannt sind, reduziert sich diese Zahl auf etwa 100 bis 150, wenn die nach Häufigkeit relevanten Krankheiten betrachtet werden. Die meisten davon sind, zumindest teilweise, genetisch determiniert.

Die Zahl der möglichen Targets für eine pharmakologische Intervention kann geschätzt werden, wenn bekannt ist, welche Gene zur Erkrankung beitragen. Die meisten Erkrankungen sind multifaktoriell, was bedeutet, dass mehrere Gene an der Entstehung beteiligt sind. Dies gilt beispielsweise für komplexe Krankheiten wie Bluthochdruck und Diabetes mellitus vom Typ 2. Die Zahl der Gene, die zum Phänotyp einer multifaktoriellen Krankheit beitragen, wird auf fünf bis zehn geschätzt.
Einer konservativen Schätzung zufolge gibt es 500 bis 1.000 wichtige krankheitsrelevante Gene – 100 relevante Erkrankungen multipliziert mit fünf bis zehn jeweils an der Krankheitsgenese beteiligten Genen. Ihre biochemischen Produkte kämen als pharmakologische Targets in Frage.
Wenn jedes dieser fünf bis zehn Genprodukte mit drei bis zehn anderen Proteinen in der Signalkette interagieren und falls auch diese Proteine gute pharmakologische Zielmoleküle sind, so ergeben sich rund 3.000 bis 10.000 potenzielle neue Zielmoleküle.
Durch die rasanten Fortschritte in der molekularbiologischen Forschung wird die vollständige Kenntnis der menschlichen Gene einschließlich ihrer Vielgestaltigkeit die Grundlage für das Verständnis der Genfunktionen in Gesundheit und Krankheit sein. Die Krankheitsursachen werden ursächlich molekularbiologisch-biochemisch verstanden und, soweit genetisch bedingt, vorhersehbar werden.
Neue molekulare Angriffspunkte auf Zielmoleküle und auf ihre pharmakologischen Wechselwirkungen werden durch das Genomprojekt erstmals identifiziert. Zu den Zielmolekülen zählen Rezeptoren, Ionenkanäle, Enzyme, Transkriptionsfaktoren usw., die mit niedermolekularen Inhibitoren/Aktivatoren beeinflusst werden können. Sind diese erkannt, werden weitere neue Hochleistungstechnologien wie Pharmacogenomics eingesetzt, um Arzneimittelkandidaten zu validieren.

Die Herausforderung für die Wissenschaftler besteht darin, dass mit Hilfe von verschiedenen Filtern und der Functional Genomics eine riesige Anzahl von Genen bearbeitet werden, bis eine kleine Anzahl von neuen hochwertigen Targets übrig bleibt. Zu den Filtern gehört neben der Genomics die Bioinformatik.

Die funktionelle Analyse und die Patentierung der Gene hat bereits begonnen. Deshalb bleibt nur ein begrenztes Zeitfenster, um in die Schlüsseltechnologien zu investieren. Die Entdeckung und Nutzung von neuen krankheitsrelevanten Genen ist unverzichtbar für die moderne Wirkstoffsuche.
Da Bayer in Pharmakologie und medizinischer Chemie die größte Kompetenz besitzt, wurde ein Partner benötigt, um einen Blitzstart in die neuen Technologien zu schaffen.

Hierzu wurde vor zwei Jahren eine Kooperation mit dem Biotech-Unternehmen Millennium Inc. in Cambridge, Massachusetts, eingegangen. Es ist die weltweit größte Zusammenarbeit auf dem Gebiet der Genomanalyse.

Millennium wird während der Kooperation insgesamt 225 krankheitsrelevante Gene und 100 fertige Assaysysteme für das Hochdurchsatzscreening (High Throughput Screening, HTS) liefern. Damit sollen die Indikationsgebiete Schmerz, Virologie, Arteriosklerose und koronare Herzerkrankung, Osteoporose, Krebs und Leberfibrose abgedeckt werden. Die Kosten der Kooperation betragen zirka 800 Millionen DM.
Bei der Suche nach den Targets müssen folgende wissenschaftliche Fragen beantwortet werden:
- Welches Protein wird von welchem Gen kodiert?
- Wo kommt es vor?
- Welche Bedeutung könnte es für die Zelle haben?
- Welche Bedeutung hat es im Krankheitszustand?
- Ist das Protein für die Arzneimittelsuche geeignet?
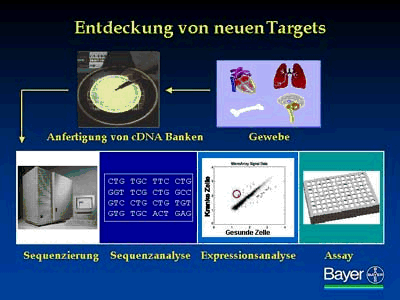
Zunächst werden Zellen und Gewebe von gesunden und kranken Organismen analysiert, in denen bestimmte Gene exprimiert werden. Der Ausgangspunkt für die Identifizierung von neuen Targets sind riesige Bibliotheken mit cDNA, die eine molekulare Kopie der Erbinformation in der jeweiligen Zelle darstellen. Die primäre Entschlüsselung der Erbinformation geschieht mit hochautomatisierten Sequenziermaschinen bei Millennium.
Anschließend folgt mit Hilfe der Bioinformatik die Sequenzanalyse der Basenpaare. Zu den wichtigen Fragestellungen gehört, ob eine Sequenz mit Proteinmolekülen korrespondiert, die für Rezeptoren, Enzyme oder Ionenkanäle von Interesse sind. Dadurch wird eine Vorauswahl von potenziellen Targets getroffen. Außerdem wird abgefragt, ob es sich um ein neues Gen handelt. Denn die Pharma Forschung hat ein vorrangiges Interesse an neuen Genen, da nur diese für innovative Wirkstoffe in Frage kommen.
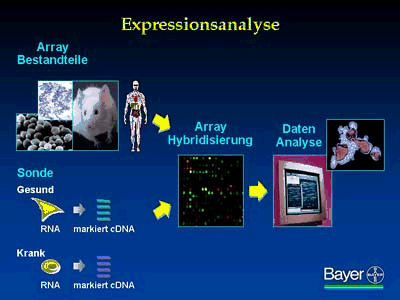
Bei der folgenden Expressionsanalyse wird bestimmt, in welchen Zellen und Geweben das entsprechende Gen vorkommt und ob die Expression in gesundem und krankem Gewebe unterschiedlich verläuft. Aufgrund der Expressionsanalyse kann eine bestimmte Krankheitshypothese aufgestellt werden.
Zur Expressionsanalyse wird ein DNA-Chip angefertigt, auf dem sich die zu analysierenden Gene in Form von DNA-Stücken befinden. Anschließend wird mit dem Chip eine Hybridisierung mit der RNA des Zielgewebes vorgenommen.
Jedes Gen ist auf dem Chip als winziges Pünktchen niedergelegt, welches nach der Hybridisierung um so heller leuchtet, je stärker das Gen im untersuchten Gewebe exprimiert wird.
Sind die Befunde der Analyse viel versprechend und besitzt das Genprodukt die Eigenschaften für eine erfolgreiche Substanzfindung, ist ein potenzielles Target entstanden. Anschließend folgt die Zusammensetzung des kompletten Gens, um den Testaufbau und das High-Throughput-Screening vornehmen zu können.

In den kommenden Jahren werden die Hochleistungstechniken zunehmend wichtiger, da in Kürze alle Gene in ihrer Sequenz bekannt sein werden. Für ein forschendes Pharmaunternehmen ist die Auswahl viel versprechender Targets essentiell, da nur sie den notwendigen Innovationsvorsprung gewährleisten.
Quelle: Pressemitteilung der Bayer AG vom 20.06.2000
Pharma-Forschung 2000plus: Mit High-Tech zu neuen Medikamenten
Hauptseite
Nachrichten
Anmerkungen
Letzte Änderungen: 21.06.2000
 Leverkusen
Leverkusen Leverkusen
Leverkusen











